高橋宙大助教、博士課程 楊歌さんらの論文がNature Communicationsオンライン版に掲載されました。
高橋宙大助教は2020年3月に東大酒井研(大学院医学系研究科)で博士(医学)号を取得し、2021年4月より東北大学大学院医学系研究科分子代謝生理学分野酒井研に着任され、研究に取り組んでいます。
寒冷を感知し、誘導性熱産生脂肪細胞(ベージュ脂肪細胞)の生成を制御する脱リン酸化酵素の発見
-クロマチン構造と共活性化因子誘導を調節し、食事誘導性肥満と耐糖能を改善-
【発表のポイント】
◆長期に持続する寒さに対し、恒温動物は脂肪組織の質を変化させることで、脂肪を燃焼して熱を産生し、体温を維持することが出来ます。
◆寒さによって熱産生を行う脂肪組織に質が変化する過程では、タンパク質脱リン酸化酵素(注1)の働きが抑制されることで、エピゲノム(注2)の変化と転写因子(注3)を介した転写の活性化が誘導されることを解明しました。
◆本研究成果は、肥満や生活習慣病に対する新たな治療法や予防法への応用が期待されます。
【用語解説】
(注1)タンパク質脱リン酸化酵素:タンパク質からリン酸基を取り除く酵素。
(注2)エピゲノム:ゲノムの塩基配列以外の後天的に書き換えられる遺伝情報を指す。具体的にはDNAのメチル化修飾、ヒストンのメチル化やアセチル化等の化学修飾など。
(注3)転写因子:特定のDNA配列を認識し、結合することができるタンパク質。他のタンパク質と相互作用することで、遺伝子の発現を強めたり、弱めたりする。

体細胞の燃焼を制御する酵素の発見
- 栄養のとりすぎによる肥満と耐糖能悪化の改善につながる成果 -
【発表のポイント】
• 長期に持続する寒さに対し、恒温動物は脂肪組織の質を変化させることで、脂肪を燃焼して熱を産生し、体温を維持することができる。
• この脂肪組織の質を変化させる過程で、タンパク質脱リン酸化酵素注1の働きが抑制されることで、エピゲノム注2の変化と転写因子注3を介した転写の活性化が誘導されることを解明した。
• 肥満や生活習慣病に対する新たな治療法や予防法への応用が期待される。
【発表概要】
栄養のとりすぎによる肥満は、2型糖尿病などの生活習慣病を引き起こす原因となります。近年、肥満が社会全体に蔓延しており、その予防・治療法の開発が喫緊の課題となっています。人を含む恒温動物は、寒冷環境に長く晒されると、エネルギーの貯蔵と供給を担う白色脂肪組織を、脂肪を燃焼して熱を産生するベージュ脂肪細胞注4に変化させる仕組みをそなえています(図1)。ベージュ脂肪細胞は脂肪を活発に燃焼させることから、ベージュ脂肪細胞の誘導が肥満症の新規治療・予防戦略として注目されています。
東北大学大学院医学系研究科/東京大学先端科学技術研究センターの酒井寿郎教授らの研究グループは、エピゲノム・プロテオミクス解析注5を行い、通常は、タンパク質脱リン酸化酵素(MYPT1-PP1β)注6がエピゲノムの書き換え酵素と転写調節の両方を制御することでベージュ脂肪細胞の誘導を抑制していることを明らかにしました。その一方で、寒冷刺激下では、活性化された細胞内でタンパク質リン酸化酵素(PKA)がMYPT1-PP1βを阻害し、ベージュ脂肪細胞を誘導することが明らかとなりました(図2)。また脂肪組織特異的にMYPT1を欠損させたマウスは、高脂肪糖質食を与えても太りにくく、耐糖能異常を引き起こしにくいことがわかりました。本研究成果は、肥満や生活習慣病に対する新たな治療法や予防法への応用が期待されます。
本研究成果は2022年9月29日にオンライン版国際科学誌『Nature Communications』に掲載されました。
【研究内容】
栄養のとりすぎによる肥満では、肥大化した脂肪細胞が遊離脂肪酸や炎症性サイトカインを多量に産生するようになります。その結果、インスリン抵抗性が誘導され、2型糖尿病などの生活習慣病が引き起こされる原因となります。近年では、先進国のみならず発展途上国においても肥満が社会全体に蔓延し、その予防・治療法の開発が喫緊の課題となっています。
恒温動物は、寒冷環境に長く晒されると脂肪組織の質を変化させ、脂肪を燃焼して熱を産生することで寒冷環境に適応する仕組みを持っています。白色脂肪組織は、エネルギーを脂肪という形で蓄える役割と、空腹時などにエネルギーを供給することで飢えから体を守る役割を担っていますが、普段は熱を産生する能力を持っていません。しかし、寒冷環境長く晒された場合は、白色脂肪組織中にベージュ脂肪細胞と呼ばれる熱産生能を有する脂肪細胞が誘導されます。このベージュ脂肪細胞が、持続的に熱を産生することで、長期に渡る寒冷環境下においても体温を維持することが出来るようになります。ベージュ脂肪細胞は、熱を産生するために活発に脂肪を燃焼することで、肥満における代謝を改善することから、ベージュ脂肪細胞の誘導が、肥満症の新規治療・予防戦略として注目されています。
寒冷刺激を脳が感知すると、交感神経終末からノルアドレナリンが分泌されます。ノルアドレナリンは脂肪細胞膜上のβアドレナリン受容体(β-AR)に結合し、細胞内でタンパク質リン酸化酵素(PKA)が活性化され、様々な基質のリン酸化を介して熱産生に関与する遺伝子群が発現されます。この細胞内シグナル伝達系(β-AR-PKAシグナリング)はベージュ化の誘導において中心的な役割を担っています。時空間的な遺伝子の発現には、エピゲノムと呼ばれる後天的なゲノム修飾を介したクロマチン構造の変化と転写因子による転写活性化の統合的な制御が必要ですが、β-AR-PKAシグナリングによって熱産生関連遺伝子の発現が制御される仕組みの詳細は、明らかになっていませんでした。
東北大学大学院医学系研究科/東京大学先端科学技術研究センターの酒井寿郎(さかい じゅろう)教授、東北大学大学院医学系研究科の松村欣宏(まつむら よしひろ)准教授、高橋宙大(たかはし ひろき)助教、楊 歌(ヨウ・カ)大学院生らの研究グループは、先行研究で同定した白色脂肪組織において寒冷刺激を感知してのベージュ化を誘導するヒストン脱メチル化酵素JMJD1A注7のリン酸化修飾に着目し、質量分析装置注8を用いて、このリン酸化を取り除く脱リン酸化酵素の網羅的な解析を行いました。その結果、新規のベージュ脂肪細胞化抑制因子として、脱リン酸化酵素の調節サブユニットであるMYPT1と触媒サブユニットであるPP1βからなる複合体を同定しました。脂肪組織特異的なMYPT1欠損マウスを作製したところ、このマウスではベージュ脂肪細胞化が顕著に誘導されており、高脂肪糖質食を与えると対照マウスと比べ、太りにくく、耐糖能やインスリン抵抗性の改善が認められました。ベージュ脂肪細胞化の抑制において、MYPT1-PP1β複合体は、JMJD1Aとミオシン調節軽鎖RLC注9の脱リン酸化を担うことで、JMJD1Aによるヒストン脱メチル化と転写因子YAP/TAZ注10を介した転写プログラムを統合的に制御していることを見出しました。またリン酸化プロテオーム解析注11から、MYPT1は、βアドレナリン受容体の下流でPKAによってリン酸化され、活性が阻害されることを見出しました。
結論:本研究によって、β-AR-PKAシグナリングが、MYPT1-PP1βの活性阻害を介して、エピゲノム変化と転写因子を介した転写調節を統合的に制御することでベージュ化を誘導する仕組みが明らかになりました。本研究成果は、肥満やインスリンの働きが悪くなる2型糖尿病をはじめとする生活習慣病の治療・予防法への応用が期待されます。
支援:本研究は、文部科学省 科学研究費 基盤研究(S)「環境因子とエピゲノム記憶による生活習慣病発症の解明」、研究活動スタート支援「ヒストン脱メチル化酵素のリン酸化制御タンパク質同定による脂肪細胞褐色化機構の解明」、国立研究開発法人 日本医療研究開発機構 革新的先端研究開発支援事業(AMED-CREST)「健康・医療の向上に向けた早期ライフステージにおける生命現象の解明」研究開発領域における研究開発課題「生活習慣病予防に働く早期ライフステージの生活環境記憶の解明」等の支援のもとで行われたものです。
【用語解説】
注1. タンパク質脱リン酸化酵素:タンパク質からリン酸基を取り除く酵素。
注2. エピゲノム:ゲノムの塩基配列以外の後天的に書き換えられる遺伝情報を指す。DNAのメチル化修飾、ヒストンのメチル化やアセチル化等の化学修飾など。
注3. 転写因子:特定のDNA配列を認識し、結合することができるタンパク質。他のタンパク質と相互作用することで、遺伝子の発現を強めたり、弱めたりする。
注4. ベージュ脂肪細胞:脂肪を消費し、熱を産生する働き持つ脂肪細胞。長期にわたる寒冷刺激で、皮下の白色脂肪組織内に誘導されてくる。肥満や糖尿病を予防する働きがある。
注5. エピゲノム・プロテオミクス解析:エピゲノム解析は、細胞の中のDNAのメチル化、ヒストンのメチル化やアセチル化などを調べる手法。プロテオミクス解析は、細胞の中の多様な種類のタンパク質を網羅的に調べる手法。
注6. MYPT1-PP1β:タンパク質脱リン酸化酵素の調節タンパク質と触媒タンパク質。複合体形成し、標的タンパク質のリン酸機を取り除く。
注7. JMJD1A:ヒストンを脱メチル化するエピゲノム修飾酵素。遺伝子の働きを抑えるエピゲノムであるヒストンH3タンパク質の9番目のリジンのジメチル化を取り除き、遺伝子の働きを活性化する。
注8. 質量分析装置:分子をイオン化し、その質量を分析する装置。一度に複数のタンパク質の質量を測定し、同定することができる。
注9. ミオシン調節軽鎖RLC:モータータンパク質であるミオシンを構成する。リン酸化されることで、アクチン繊維との相互作用を促し、アクトミオシン繊維の張力発生に関与する。
注10. 転写因子YAP/TAZ:アクトミオシン細胞骨格の張力など種々の機械的な刺激により、細胞質から核に移行し、遺伝子の働きを活発化する転写調節因子。
注11. リン酸化プロテオーム解析:細胞内のタンパク質のリン酸化修飾の状態を包括的に解析する手法。
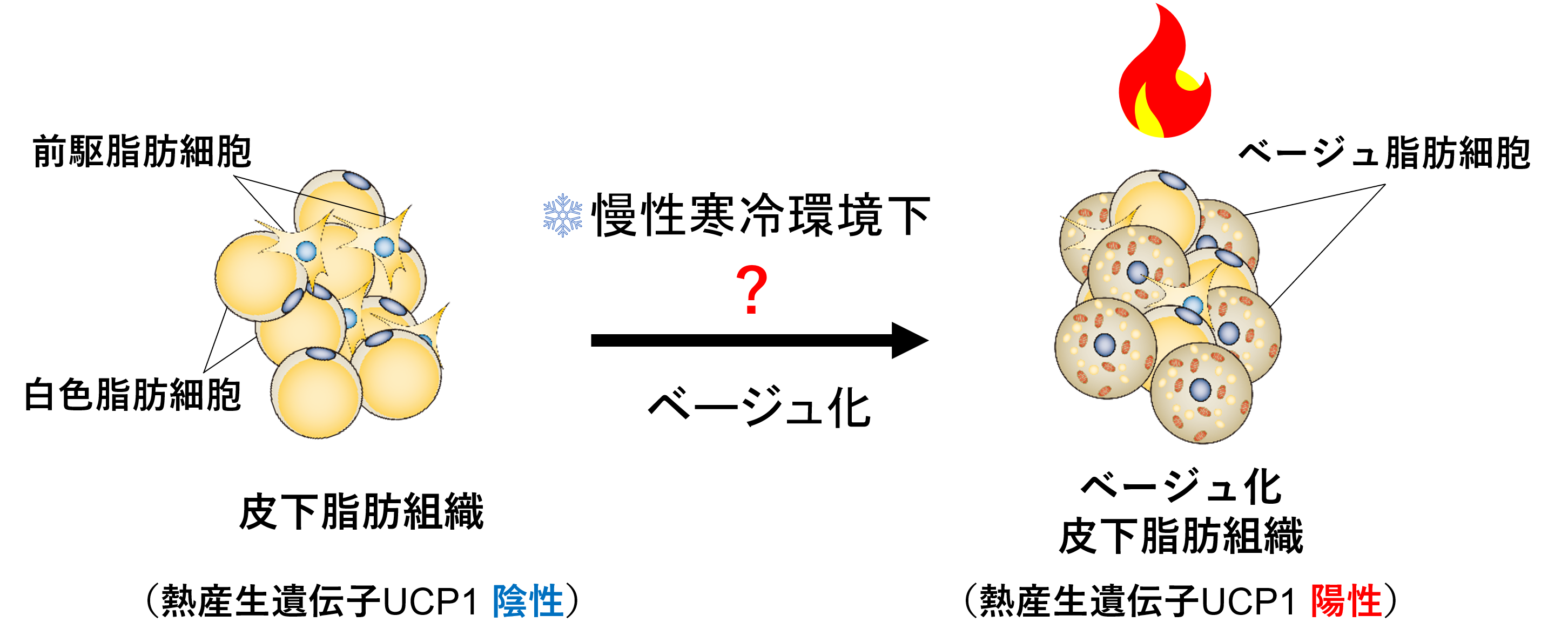
図1.長期的な寒冷環境によって、白色脂肪組織中にベージュ脂肪細胞が誘導され、慢性の熱産生を担う。
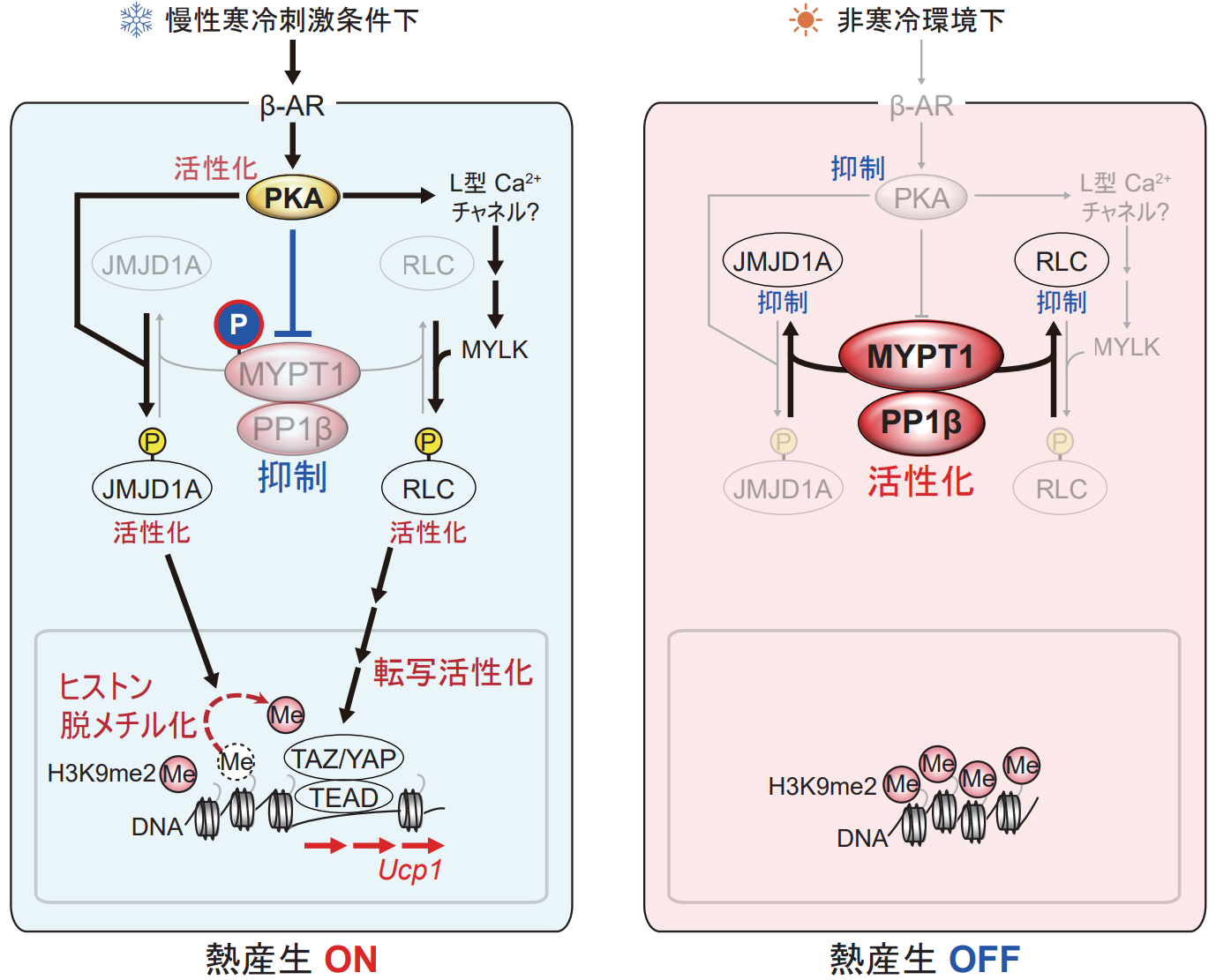
図2.寒さによって白色脂肪細胞がベージュ脂肪細胞になる仕組み
図の中の丸で囲った『P』はタンパク質のリン酸化、『Me』はヒストンH3タンパク質の9番目のリジンのジメチル化を表している。慢性寒冷刺激条件下では、MYPT1-PP1βの働きは抑制され、JMJD1AとRLCは活性化され、熱産生関連遺伝子がONになる。非寒冷環境下では、MYPT1-PP1βは活性化され、JMJD1AとRLCの働きは抑制され、熱産生関連遺伝子がOFFになる。
【論文情報】
Title: MYPT1-PP1β phosphatase negatively regulates both chromatin landscape and co-activator recruitment for beige adipogenesis
Author: Hiroki Takahashi*, Ge Yang*, Takeshi Yoneshiro, Yohei Abe, Ryo Ito, Chaoran Yang, Junna Nakazono, Mayumi Okamoto-Katsuyama, Aoi Uchida, Makoto Arai, Hitomi Jin, Hyunmi Choi, Myagmar Tumenjargal, Shiyu Xie, Ji Zhang, Hina Sagae, Yanan Zhao, Rei Yamaguchi, Yu Nomura, Yuichi Shimizu, Kaito Yamada, Satoshi Yasuda, Hiroshi Kimura, Toshiya Tanaka, Youichiro Wada, Tatsuhiko Kodama, Hiroyuki Aburatani, Min-Sheng Zhu, Takeshi Inagaki, Timothy F. Osborne, Takeshi Kawamura, Yasushi Ishihama, Yoshihiro Matsumura#, Juro Sakai#(*筆頭著者、 #責任著者)
論文タイトル:MYPT1-PP1β脱リン酸化酵素複合体は、クロマチン構造と共活性化因子誘導を調節する事で、ベージュ化を抑制する。
著者:高橋 宙大、楊 歌、米代 武司、阿部 陽平、伊藤 亮、楊 超然、中園 純菜、岡本(勝山) 真由美、内田 あおい、荒井 誠、神 仁美、崔 賢美、ミグマル トゥメンジャルガル、謝 詩雨、張 吉、寒河江 陽菜、趙 亞楠、山口 玲、野村 優、清水 佑一、山田 魁人、安田 聡、木村 宏、田中 十志也、和田 洋一郎、児玉 龍彦、油谷 浩幸、朱敏 生、稲垣 毅、ティモシー オスボーン、川村 猛、石濱 泰、松村 欣宏、酒井 寿郎
雑誌名:Nature Communications
DOI番号:10.1038/s41467-022-33363-0
【研究者情報】
東北大学大学院医学系研究科 分子代謝生理学分野
東京大学先端科学技術研究センター 代謝医学分野
教授 酒井 寿郎
研究者 https://orcid.org/0000-0003-4043-1035
https://researchmap.jp/jmsakai/?lang=japanese
研究室 http://www.metab.med.tohoku.ac.jp/