Inagaki T1,2, Iwasaki S1, Matsumura Y, Kawamura T, Tanaka T, Abe Y, Yamasaki A, Tsurutani Y, Yoshida A, Chikaoka Y, Nakamura K, Magoori K, Nakaki R, Osborne TF, Fukami K, Aburatani H, Kodama T, Sakai J2 (1 equal contribution, 2 corresponding authors)
The FBXL10/KDM2B Scaffolding Protein Associates with Novel Polycomb Repressive Complex-1 to Regulate Adipogenesis
J Biol Chem. 2015 Feb 13;290(7):4163-77. doi: 10.1074/jbc.M114.626929. Epub 2014 Dec 22. [DOI] [PubMed]
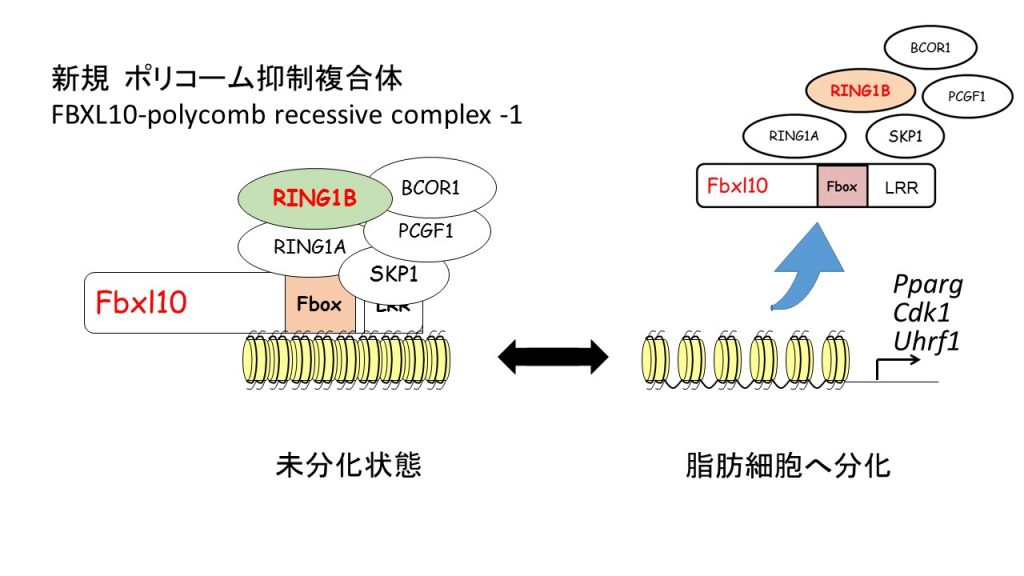
FBXL10は新規なポリコーム複合体を形成し脂肪細胞の分化を制御する
岩崎 聡さん、稲垣 毅准教授の論文JBCにアクセプト。
脂肪細胞がどのように分化しているかの機構を知ることは、肥満の進行やメタボリック症候群といった生活習慣病を理解する上で重要です。本研究では脂肪細胞分化を抑制する新規の機構を解明しました。
脂肪細胞分化は、誘導分化刺激に伴って遺伝子発現が次々にリレーされ、最終的にマスターレギュレータである核内受容体PPARγの発現にたどり着き、脂肪細胞として確立します。PPARγの活性化薬は糖尿病患者さんのインスリンの効きを良くする薬として臨床の場で広く使われています。一方、この転写カスケードとは別に、最終的に脂肪細胞という記憶が定着するためにエピゲノムによる修飾も必要です。我々は脂肪細胞分化とともに誘導されてくるエピゲノム酵素FBXL10(別名KDM2B、JHDM1B)が分化誘導を制御することを見いだしました。プロテオミクス解析の結果、あらたにRING1BというES細胞の未分化状態を制御するのに重要な分子がFBXL10とタンパク質複合体を形成することが見いだされ、そしてこの複合体が脂肪細胞分化のマスターレギュレータである核内受容体PPARγの発現や細胞周期制御遺伝子の発現を調節することがマイクロアレイ法とChIP-Seqから解明されました。本研究は、従来iPS/ES細胞が無秩序に分化しないように未分化状態を維持するにあたってエピゲノムを制御するという重要な役割を果たすポリコームタンパク質群(RING1Bなど)が、脂肪細胞の分化においてFBXL10と新規な複合体を形成することを示しました。その結果、FBXL10が細胞の未分化性と脂肪細胞への分化の制御に関わるという役割を提示しました。FBXL10は脂肪の多い餌を食べて肥満したマウスの白色脂肪にも多く発現していたため、将来的に肥満の制御につながる可能性が考えられます。
Abstract
Polycomb repressive complex 1 (PRC1) plays an essential role in the epigenetic repression of gene expression during development and cellular differentiation via multiple effector mechanisms including ubiquitination of H2A and chromatin compaction. However, whether it regulates the step-wise progression of adipogenesis is unknown. Here we show that FBXL10/KDM2B is an anti-adipogenic factor that is up-regulated during the early phase of 3T3-L1 preadipocyte differentiation and in adipose tissue in a diet induced model of obesity. Interestingly, inhibition of adipogenesis does not require the JmjC demethylase domain of FBXL10 but it does require the F-box and leucine rich repeat (LRRs) domains which we show recruit a non-canonical polycomb repressive complex 1 (PRC1) containing RING1B, SKP1, PCGF1 and BCOR. Knockdown of either RING1B or SKP1 prevented FBXL10 mediated repression of 3T3-L1 preadipocyte differentiation indicating that PRC1 formation mediates the inhibitory effect of FBXL10 on adipogenesis. Using ChIP-seq we show that FBXL10 recruits RING1B to key specific genomic loci surrounding the key cell-cycle and adipogenic genes Cdk1, Uhrf1, Pparg1 and Pparg2 to repress adipogenesis. These results suggest that FBXL10 represses adipogenesis through targeting a non-canonical PRC1 complex to repress key genes (e.g. Pparg) that control conversion of pluripotent cells into the adipogenic lineage.
【学生・研究者向け解説】
脂肪細胞がどのように分化しているかの機構を知ることは、肥満の進行やメタボリック症候群といった生活習慣病を理解する上で重要です。本研究では3T3-L1脂肪前駆細胞を用いて脂肪細胞の分化機構を検討し、脂肪細胞分化を抑制する新規の機構を解明しました。
脂肪前駆細胞は細胞同士の接触によって増殖が停止したのち分化誘導剤で処理すると、およそ24時間後と48時間後の2回の細胞周期からなる一過性増殖期(クローナルエクスパンジョン期)を経て8日間で脂肪細胞に分化します。この時、複数の転写調節因子が連続的もしくは互いに遺伝子発現を制御するカスケードが存在し、その中でも核内受容体PPARγはマスター制御因子として働くことが知られています。
最近、ゲノム配列によらない遺伝子の発現制御機構であるエピゲノム制御機構が生活習慣病の発症や細胞分化との関わりで注目されていますが、私たちはエピゲノム因子の一つであるFBXL10(別名KDM2B、JHDM1B)が脂肪細胞分化過程において発現が一過性に上昇することを見出しました。FBXL10の発現は高脂肪食負荷によって肥満したマウスの白色脂肪において約20倍に上昇したことから、FBXL10が脂肪細胞分化や肥満に関係していると考えられました。そのため、脂肪前駆細胞にFBXL10を強制発現したところ、脂肪細胞への分化が抑制され、この細胞ではクローナルエクスパンジョン期における2回目の細胞周期が停止していることが明らかになりました。この分化抑制はFBXL10タンパクのJmjCドメインを必要とせず、F-BoxドメインとLRRドメインを必要としました。F-BoxドメインとLRRドメインを介したタンパク相互作用に注目してショットガンプロテオミクス解析法をおこないFBXL10に結合するタンパク質を検討したところ、BCOR、RING1B、SKP1、PCGF1等が見出されました。このタンパク複合体はポリコーム抑制複合体(PRC1)として、クロマチンコンパクションやヒストンのユビキチン化修飾に関わることが最近報告されています。siRNAを用いてRING1BやSKP1をノックダウンするとFBXL10による脂肪細胞分化抑制や細胞周期の停止が解除されたため、このタンパク複合体は機能的な複合体であることが明らかになりました。一方、CUL1はF-Boxドメインを持つタンパクとSKP1に関連が深く、ポリユビキチン化によるタンパク分解に重要なタンパクですが、FBXL110による脂肪細胞分化抑制には影響しませんでした。FBXL10を含むPRC1複合体が標的とする遺伝子を決定するため分化誘導後48時間後の細胞を用いて遺伝子発現解析とChIPシークエンス解析とを行ったところ、細胞周期関連遺伝子(Cdk1, Uhrf1)やPPARγ遺伝子の遺伝子発現がFBXL10の強制発現によって抑制されることが明らかになり、RING1BがFBXL10によってこれらの遺伝子領域に誘導されることが示されました。以上の結果から、FBXL10がPRC1複合体を形成して標的遺伝子の発現を制御することで脂肪細胞分化を抑制するという機構が示されました。生理的にはFBXL10の発現は脂肪細胞分化過程において一過性に上昇するとともに、肥満マウスの白色脂肪において高発現します。この意義として、FBXL10が多能性未分化細胞から脂肪細胞への分化制御に関わることが示唆されます。