新規なクロマチン構造 (H3K9me3/H3K4) ビバレントクロマチン)の発見。脂肪組織中の、前駆脂肪細胞が脂肪細胞にならないようにとどめている仕組みを解明しました。Molecular Cell
Yohei Abe, Yosuke Fujiwara, Hiroki Takahashi, Yoshihiro Matsumura, Tomonobu Sawada, Shuying Jiang, Ryo Nakaki, Aoi Uchida, Noriko Nagao, Makoto Naito, Shingo Kajimura, Hiroshi Kimura, Timothy F. Osborne, Hiroyuki Aburatani, Tatsuhiko Kodama, Takeshi Inagaki & Juro Sakai
Histone demethylase JMJD1A coordinates acute and chronic adaptation to cold stress via thermogenic phospho-switch
Nature Commun. 9, Article number: 1566 (2018) . doi: 10.1038/s41467-018-03868-8
https://www.nature.com/articles/s41467-018-03868-8
プレスリリース
東京大学先端科学技術研究センター
http://www.rcast.u-tokyo.ac.jp/pressrelease/2018/20180419release_rcast_ja.html
English
https://www.u-tokyo.ac.jp/en/utokyo-research/research-news/enduring-cold-temperatures-alters-fat-cell-epigenetics.html
東北大学
https://www.tohoku.ac.jp/japanese/2018/04/press20180420-shibou-nensho.html
国内及び海外のメディアにも取り上げられています。
ABC News 「Can being cold help you lose weight? 」
https://abcnews.go.com/Health/cold-lose-weight/story?id=54631686
GEN NEWS Highlights 「Cold Temp Exposure Causes Epigenetic Changes in Fat Cells」
EurekAlert! The Global source for Science News 「Enduring cold temperatures alters fat cell epigenetics」
https://www.eurekalert.org/pub_releases/2018-04/uot-ect041718.php
Diabetes.co.uk the global diabetes community 「Cold temperatures could reduce obesity and type 2 diabetes」
mail Online- health 「Being cold can help you LOSE weight: Study finds a chilly swim could blitz fat faster than hot yoga」
WJBD Health News 「Can being cold help you lose weight?」
http://www.wjbdradio.com/health-news/2018/04/24/can-being-cold-help-you-lose-weight
ASIAN SCIENTIST Magazine 「Epigenetics Makes White Fat Turn Beige」
https://www.asianscientist.com/2018/05/in-the-lab/white-fat-epigenetics-jmjd1a/
朝日新聞デジタル
「燃えやすい体脂肪に変える「スイッチ」 東大・東北大、マウスで酵素特定」
https://digital.asahi.com/articles/DA3S13459120.html?iref=sp_ss_date
「体脂肪が燃えやすい体質になるしくみ、東大など解明」
https://digital.asahi.com/articles/ASL4M7R3FL4MUBQU00Z.html
「寒い環境が長いと体脂肪燃えやすく マウス実験で裏付け」
https://digital.asahi.com/articles/ASL4K66J1L4KULBJ012.html
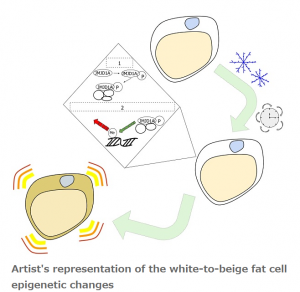
恒温動物は寒冷環境に適応するしくみを持っていますが、この際に重要な役割を持つのが脂肪細胞です。急激に環境の温度が低下すると交感神経系が活性化し、褐色脂肪細胞(注1)で脂肪が燃焼され、熱が産生されます。一般によく知られている白色脂肪組織は、エネルギーを脂肪として貯めることが主たる役割であるため熱産生能を有しておらず、熱産生に関与する遺伝子(注2)も発現していません。しかし、寒冷環境が長期に持続すると、白色脂肪組織でも、脂肪燃焼と熱産生に関わる遺伝子が誘導され、寒冷環境に個体が耐えられるよう適応します。
本来、細胞には「エピゲノム」というゲノムの後天的な調節機構が備わっており、エピゲノムのしくみにより細胞の種類ごとに働く遺伝子(活動中)と働かない遺伝子(休止中)が明確に決められています。脂肪を貯める機能を担う白色脂肪細胞では、通常は脂肪燃焼や熱産生に関わる遺伝子は「休止中」で、働くことができません。では、恒温動物が長期の寒冷刺激を受けると、どのようにして遺伝子に寒冷環境に適応した体質への変化を促すのでしょうか?
東京大学先端科学技術研究センター/東北大学 大学院医学系研究科の酒井寿郎 教授、群馬大学生体調節研究所の稲垣 毅 教授、学術振興会特別研究員の阿部陽平、東京大学大学院薬学系研究科大学院生の藤原庸右および東京大学大学院医学系研究科大学院生の高橋宙大らの研究グループは、遺伝子がエピゲノムによって通常は「休止中」となっている白色脂肪組織に着目し、慢性の寒冷刺激による脂肪組織のベージュ化過程におけるエピゲノム解析を行いました。寒冷刺激を受けるとアドレナリン作用によってヒストン脱メチル化酵素JMJD1A(注3)がリン酸化され、寒冷刺激が持続すると必要な機能を獲得したJMJD1A がエピゲノム変化を介して「休止中」だった脂肪燃焼と熱産生に関わる遺伝子群を「活動中」にし、遺伝子を発現させて、ベージュ化を誘導し、寒冷環境に慢性的に適応するしくみがあることがわかりました(図)。本成果は、肥満や生活習慣病に対する新規治療法の開発に応用できるものと期待されます。
本研究は、文部科学省 科学研究費 基盤研究(S)「環境因子とエピゲノム記憶による生活習慣病発症の解明」、新学術領域研究「温度生物学」、文部科学省の産学連携プログラムである先端融合領域イノベーション創出拠点の形成プログラム「システム疾患生命科学による先端医療技術開発」等の支援のもとで行われたものです。本研究成果は国際科学誌 Nature Communications に2018年4月19日付オンライン版で発表されます。
(注1)褐色脂肪細胞:一般的によく知られている白色脂肪細胞は脂肪の蓄積を行うのに対し、褐色脂肪細胞は体を震わせないでからだの熱を産生することが可能である。
(注2)熱産生に関与する遺伝子:交感神経から分泌されるノルアドレナリンなどの受容体である β アドレナリン受容体(Adrb1)や、ミトコンドリアにある脱共役タンパク質(Ucp1)など、熱を産生するために必要な鍵となるタンパク質群をコードする遺伝子群を示す。
(注3)JMJD1A:ヒストン脱メチル化酵素の一つで、エネルギー消費、性決定、腫瘍形成、低酸素による応答など、環境変化に多様に応答して機能する。
A new study in fat cells has revealed a molecular mechanism that controls how lifestyle choices and the external environment affect gene expression. This mechanism includes potential targets for next-generation drug discovery efforts to treat metabolic diseases including diabetes and obesity.
Researchers tracked how the epigenome changes after long-term exposure to cold temperatures, and how those changes cause energy-storing white fat cells to become heat-producing brown-like, or “beige,” fat cells.
“We believe that this is the first time that anyone has collected data to prove that there are two steps between the environmental stimuli and epigenetic changes,” said Professor Juro Sakai from the University of Tokyo and Tohoku University, an expert in the epigenetics of metabolism.
Gene expression is regulated by epigenetics – patterns of chemical signals that are “above” the gene sequence. An individual’s gene sequence is determined at conception, but the external environment and an individual’s lifestyle can change the epigenetic sequence throughout a lifetime, continually altering how genes are expressed. The scientific community has long suspected that there may be a stepwise process inside the cell to manage environmental influences on the epigenome, but no specific molecular mechanisms had been identified previously.
Shivering creates body heat short-term by warming up the muscles, but thermogenesis is the chemical process by which brown fat cells can use lipids (fat) to create heat to keep the body warm long-term. Brown fat is regarded as healthier and is not associated with the metabolic diseases linked to excess white fat.
When organisms are cold for a long time , the sympathetic nervous system responds by releasing adrenaline. If cold temperatures persist, those adrenaline signals eventually reach white fat cells. Step one of the environmental epigenetic control pathway is that the cell initiates a specific change to one amino acid in a protein named JMJD1A and this altered JMJD1A recruits other proteins. In step two, this JMJD1A protein complex is recruited to genes that initiates thermogenesis and changes their epigenetic pattern so that they are active. Those epigenetic changes transform white fat cells into what researchers refer to as “beige fat cells,” which perform thermogenesis like brown fat cells.
More beige fat cells and fewer white fat cells could reduce the symptoms or negative health outcomes of metabolic diseases like diabetes, obesity. Although transforming white fat cells into beige fat cells and increasing thermogenesis is naturally a stress response to chronic cold exposure involving adrenaline, researchers report that the same white-to-beige fat cell transition can be caused without adrenaline or cold stress.
“Understanding how the environment influences metabolism is scientifically, pharmacologically, and medically interesting. Our next experiments will look more closely at epigenetic modifications within the thermogenesis signaling pathway so that we may manipulate it,” said Sakai.
Current drugs for metabolic diseases rely on hormones that are systemic throughout the entire body or drugs that target entire proteins. Sakai’s research team imagines a future where metabolic diseases can be treated by targeting single amino acids.
The JMJD1A protein is involved in a wide variety of other processes, including cancer, infertility, stem cell renewal, and sex determination of an embryo. However, Sakai’s research team has discovered sites within the protein sequence that are extremely specific for controlling different activities of the protein. Manipulating those specific amino acids may provide precision drug targets.
The published study included research using mice and mouse cells. Chronic cold exposure in humans can include living in places that are often below 4oC (39.2oF). In addition to living in cold environments, brown fat thermogenesis is essential for newborn infants anywhere in the world as they acclimatize from the 37oC (98.6oF) temperature in the uterus to common room temperature of approximately 23oC (73.4oF).